目前中国🇨🇳抗肿瘤药物研发处于快速发展阶段,中国肿瘤患者对于药物的安全性、治疗体验和生存质量都有了更高的期望。
当你们看到中国🇨🇳至少有超过100家公司在研发PD-1,还有另外100家公司在立项CAR-T,me-too创新药一定是出了问题。
很多业内人士都在质疑,me-too创新药是不是太泛滥了?
海量的资金被浪费还是小事,至少这些资金培育了成熟的CRO产业,对于整个行业还算有歪打正着的贡献。
最为可惜的是宝贵的临床资源被占用,有限的病人遭到无数雷同的临床试验项目的哄抢,甚至本身不具备判断能力的病人被说服进入最终是"me-worse"药物的临床试验,反而耽误了有效的治疗。
当然,下文的这个文件已经开始出现不利于泰格医药(SZ300347)的声音。
抗肿瘤药物的研发,从以临床需求为导向→以临床价值为导向,逐渐成为普遍共识。
2021年7月2日,中国🇨🇳药品审评中心CDE发布了《以临床价值为导向的抗肿瘤药物临床研发指导原则》的征求意见稿。
该文件有28页,以非常鲜明的语言明确提出:

意思非常明确了:以后要申报me-too创新药临床试验,要在现有治疗方案中选择最能打的那个去对比。
既往那种技巧性地选择一个传统治疗方案(化疗)作为对比,以求做出有效(better),这种“投机”式的玩法未来行不通了。
比如说,某家药企想做PD-1在某个适应症上的临床试验,如果君实生物-U(SH688180)的PD-1已经在这个适应症获批。那么,请你的PD-1在3期临床试验头对头对照,打败目前已经获批的最好品种,否则上市免谈。
此时,对于me-too创新药的负面影响在哪里?
如果真正有实力,能做到"me-better",仍然有生存的空间。
如果是投机为主的"me-worse"药物,基本就没有上市的可能了。
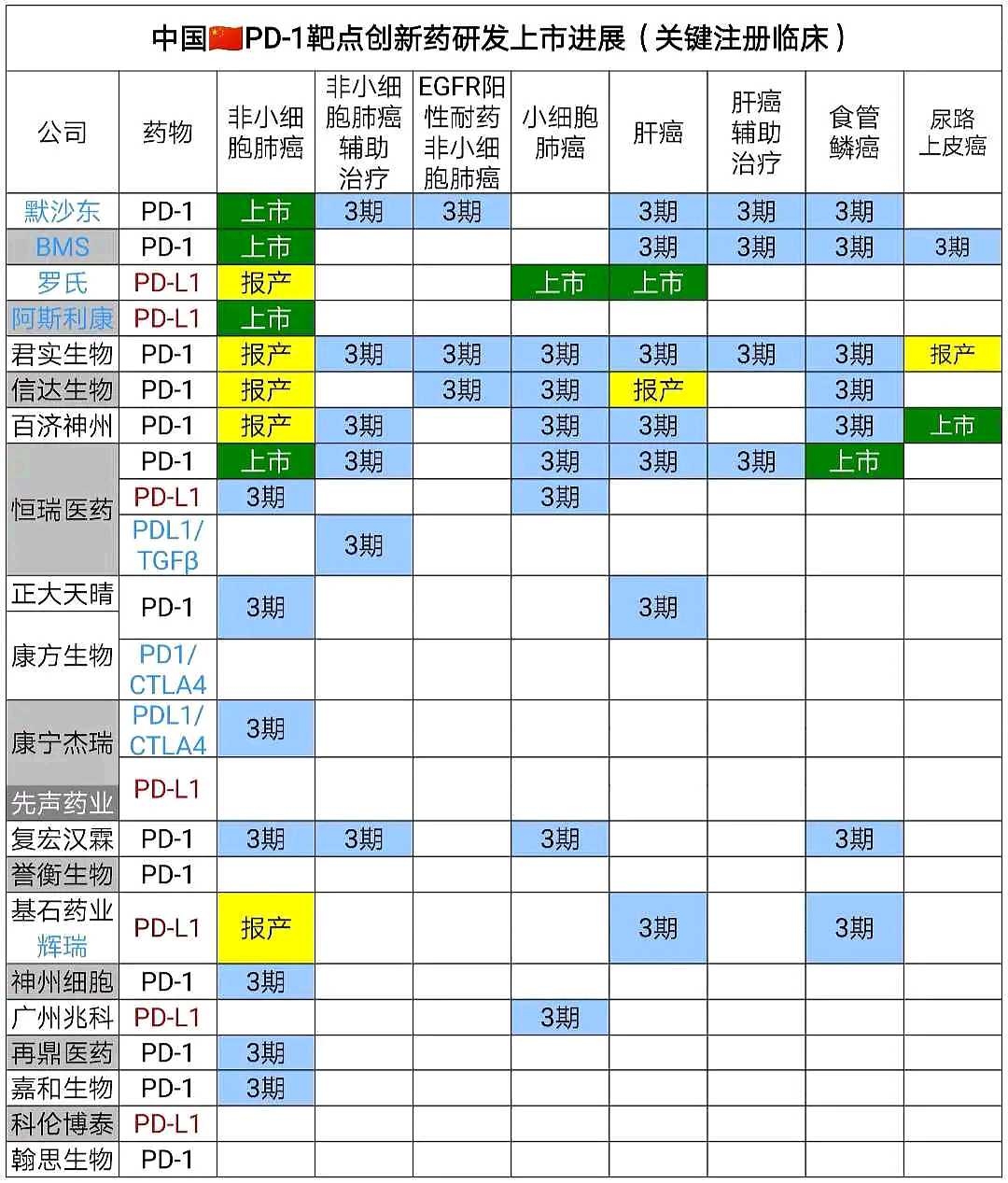
例如,在非小细胞肺癌(鳞癌+非鳞癌)一线治疗这种大适应症,PD-1获批的难度大大提升了。
①例如,康方生物的PD-1/CTLA-4双抗(AK104),假设打算明年启动非小细胞肺癌一线治疗的3期临床试验。对照组一定是科伦药业(SZ002422)PD-L1不仅仅是缺席三大适应症。
即使是准备2期临床单臂试验报产的——霍奇金淋巴瘤三线治疗这种末流小适应症,已经有恒瑞医药、信达生物、
综上所述,以